Mutationen
Teil 1: Grundinformationen
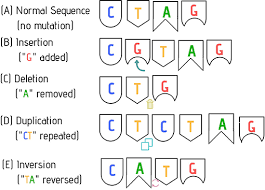
Informiere dich zunächst auf der folgenden Seite über Genmutationen:
https://bio-gymnasium-altona.webnode.com/l/genmutationen-infoseite/
Lies dir anschließend den folgenden Infotext durch und bearbeite die Aufgaben 1-3 auf der zweiten Seite:
Das Passwort zum Anzeigen der Datei erhälst du vom Lehrer
Teil 2: Beispiel Sichelzellanämie


Alle Lebewesen und somit auch der Mensch
sind nach den selben Prinzipien aufgebaut. Die Erbinformation wird von den
Eltern in Form von DNA an die Kinder weitergegeben. Somit besitzt jeder Mensch
je nach Eltern unterschiedliche Gene. Aus jedem Gen wird durch den Prozess der
Proteinbiosynthese ein Protein hergestellt.
Gene können auch von der Umwelt an- und abgeschaltet werden. So kann sich jeder Organismus der Umwelt anpassen. Z.B. wird bei starker Sonnenbestrahlung der Haut das Melanin-Synthese-Enzym-Gen in den Hautzellen angeschaltet, was zur Produktion des braunen Hautfarbstoffes Melanin dient.
Am Beispiel des Melanins wird deutlich, wie die unteren Organisationsebenen die darüber liegenden Ebenen bestimmen (siehe Abb. 2). So bestimmt die DNA z.B. indirekt die Hautfarbe eines Menschen, indem auf der DNA liegende Gene Proteine herstellen, die den Stoffwechsel (Melanin-Herstellung) steuern, was wiederum zu Veränderungen in der Zelle, dem Gewebe (Gewebe mit Melanin-Einlagerungen) und letztlich den Organen (dunkle Haut) und dem Organismus (z.B. dunkelhäutiger Mensch) führen.
Nach dem oben beschriebenen Mechanismus werden alle Merkmale aller Lebewesen erzeugt (vom Blutdruck, über die Größe bis zur Hautfarbe und Geschlecht). Der Mensch besitzt ca. 30 000 Gene. Diese werden regelmäßig, täglich 1000fach aktiviert und in Proteine und letztlich Merkmale des Organismus umgesetzt. Leider kommt es bei diesen komplizierten Prozessen gelegentlich zu Fehlern. Besonders schlimm ist es, wenn die unterste (molekulare) Organisationsebene des Lebens verändert ist, da sie alle anderen höheren Ebenen beeinflusst und steuert.
Die Sichelzellanämie ist eine Erbkrankheit, die besonders häufig in Afrika vorkommt. Die Ursache ist eine Mutation, durch die das Protein Hämoglobin, das für den Sauerstofftransport durch unsere roten Blutzellen verantwortlich ist, nicht mehr richtig funktioniert. Die Folge ist eine verringerte Leistungsfähigkeit, außerdem verformen sich die roten Blutzellen durch die fehlerhaften Hämoglobin-Moleküle zu sichelförmigen Gebilden(siehe Abb.3), verklumpen miteinander und verstopfen kleine Blutgefäße. Wegen den dadurch hervorgerufenen Durchblutungsstörungen kommt es zu Organschäden, Schlaganfällen und Herzinfarkten.
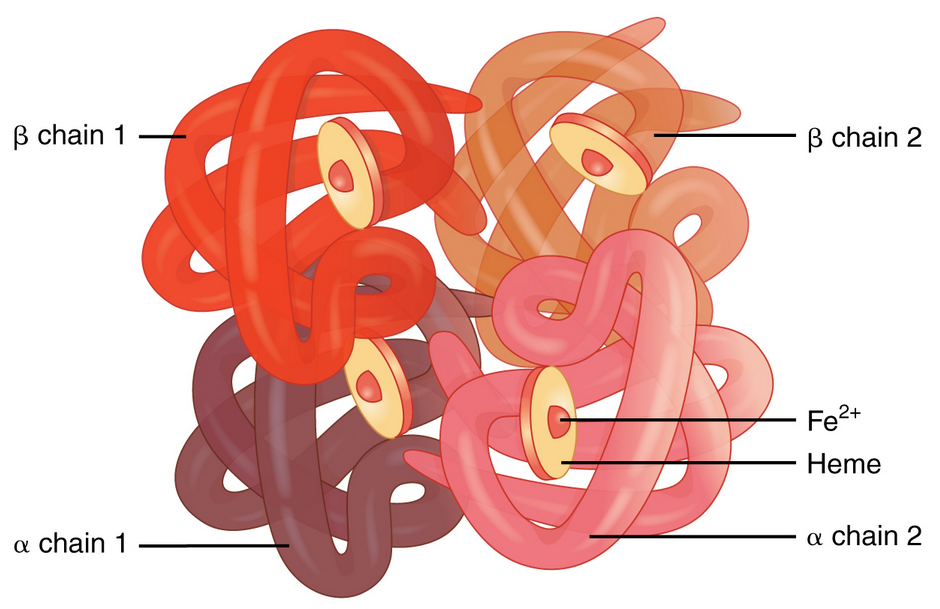
Zunächst
mehr Informationen zur Veränderung des Hämoglobins bei der
Sichelzellanämie: Für den Sauerstofftransport im Blut ist das
Hämoglobin-Protein in den roten Blutkörperchen verantwortlich. Das
Hämoglobin hat eine Quartärstruktur aus 4 Tertiärstruktur-Untereinheiten (siehe Abb. 4), von denen je zwei identisch sind. Beim Menschen unterscheidet man
die Untereinheiten α und β.
Für beide Untereinheiten (α und β) besitzen wir jeweils ein Gen, also ein Gen für die α-Untereinheiten und ein Gen für die β-Untereinheiten).
Der Nobelpreisträger Linus Pauling konnte 1949 nachweisen, dass die
Ursache für die Sichelzellanämie in einer veränderten
Aminosäuresequenz der β-Untereinheiten liegt, die durch eine Punktmutation (Missense-Mutation) im Gen für die β-Untereinheiten entsteht.
Die
veränderte Form der Sichelzellen kommt zustande, weil sich die durch
die Mutation veränderten Hämoglobin-Proteine im Gegensatz zu den
normalen Hämoglobin-Proteinen zu einer kristallartigen Struktur
zusammenlagern bzw. miteinander verklumpen.
Sie bilden also einen zusammengelagerten Feststoff und sind nicht mehr im Cytoplasma der roten Blutkörperchen gelöst, wodurch sie ihre Funktion (den Sauerstofftransport) nicht mehr erfüllen können. Die durch die Mutation veränderte Aminosäure befindet sich an der Oberfläche des Hämoglobin-Moleküls.
Da die Krankheit autosomal-rezessiv vererbt wird, sind homozygot rezessiv erkrankte Personen stärker betroffen und haben eine stärker verminderte Lebenserwartung als heterozygot Erkrankte. Nur homozygote Träger des Sichelzellgens zeigen die starke Ausprägung der Krankheit, bei der das gesamte Hämoglobin abnormes Sichelzellhämoglobin (irreguläres Hämoglobin) ist. In heterozygoten Trägern ist dagegen nur ein Teil des Hämoglobins fehlerhaft. Die Sichelzellen werden schnell abgebaut da sie weitestgehend funktionsunfähig sind. Jedoch liegen auch bei Erkrankten nicht die gesamte Zeit die roten Blutkörperchen in der Sichelform vor. Die Zusammenlagerung der Hämoglobin-Moleküle und die dadurch ausgelöste Umformung der roten Blutkörperchen zu Sichelzellen geschieht nur, wenn die Patienten körperlich stark aktiv sind und im Blut ein niedriger Sauerstoffgehalt vorliegt.
Übungen:
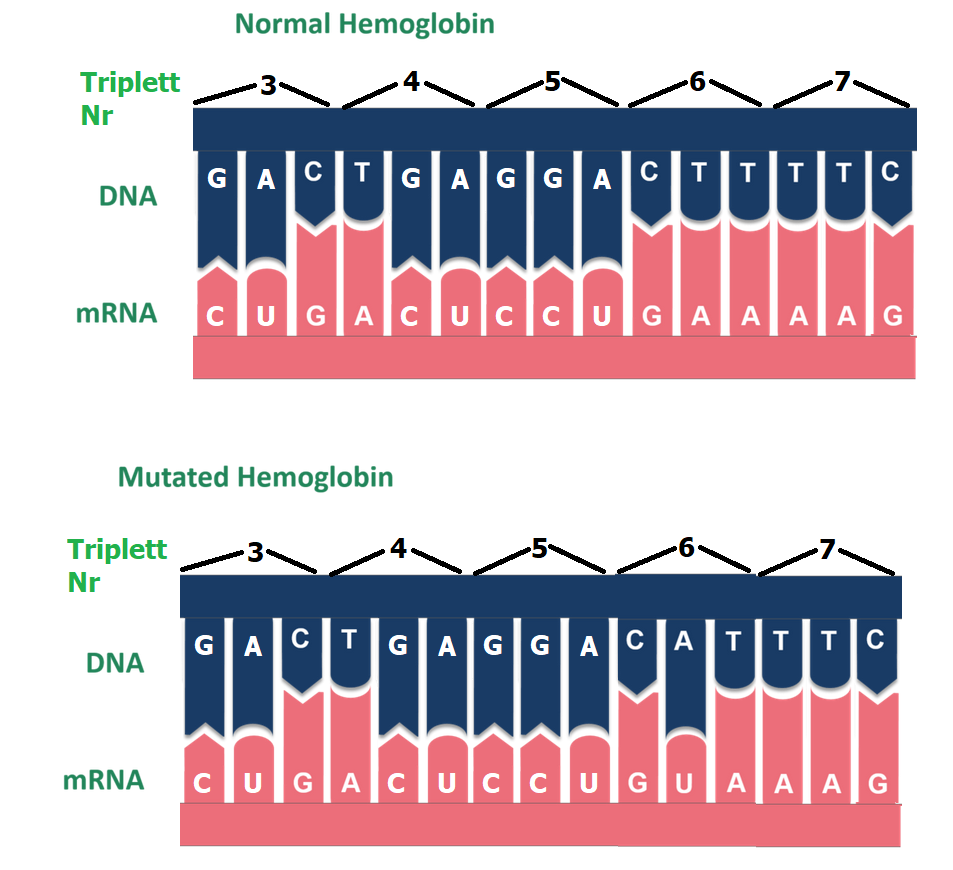
1. Erstelle mit Hilfe des Genetischen Codes (Link) die Aminosäuresequenz-Ausschnitte für das normale Gen der beta-Untereinheit des Hämoglobins und für das mutierte.
2. Stelle z.B. in Form einer Tabelle dar, welche Veränderungen sich bei der Erbkrankheit der Sichelzellenanämie auf den verschiedenen Organisationsebenen ergeben.

3. Entwickle ausgehend vom Triplett Nr. 3 im DNA-Ausschnitt des normalen Beta-Untereinheiten-Gens aus Abbildung 5 eine Triplett-DNA-Sequenz (für Triplett Nr. 3), die eine stumme Mutation enthält. Link
Beachte dabei, dass folgende Basen zueinander komplementär sind:
A (in DNA) und U (in mRNA) bzw A (in mRNA) und T (in DNA)
G und C
4. Entwickle ausgehend vom Triplett Nr. 7 im DNA-Ausschnitt des normalen
Beta-Untereinheiten-Gens aus Abbildung 5 eine Triplett-DNA-Sequenz (für Triplett Nr. 7), die eine Nonsense-Mutation enthält. Link
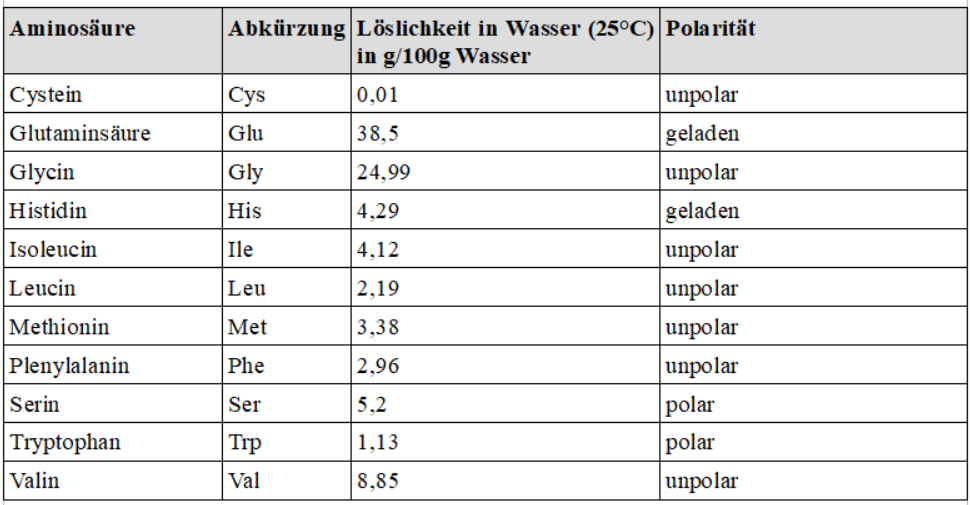
5. * (Zusatz) inde mit Hilfe der folgenden Tabelle eine Erklärung dafür, wieso sich die
Hämoglobin-Moleküle durch die Mutation innerhalb der roten
Blutkörperchen zu Kristall-Strukturen (Feststoff) zusammenlagern und
nicht mehr im Cytoplasma gelöst sind.
Quellen: Alle Abbildungen stammen aus Wikimedia Commons (Creative Commons Lizenz) und wurden teilweise bearbeitet